In de microbiologie zijn niet alleen aantallen van belang. Of het nu gaat om gewenste micro-organismen zoals starterculturen of probiotica of om ongewenste pathogenen of bedervers, steeds is het belangrijk om te weten in welke conditie deze micro-organismen zich bevinden. De fysiologische conditie van individuele cellen kan immers sterk variëren waardoor cellen niet allemaal dezelfde viabiliteit of levensvatbaarheid hebben. Bij gewenste micro-organismen is een hoge viabiliteit een cruciale eigenschap. Bij ongewenste micro-organismen is het dan weer belangrijk om, bv na pasteurisatie of sterilisatie, te weten of cellen voldoende werden afgedood of dat ze in die mate verzwakt zijn dat ze niet meer in staat zijn te groeien.
TNO ontwikkelde een gepatenteerde methode waarmee de fysiologische conditie van cellen bepaald kan worden. Voor de bepaling van de Real Time Viability (RTV) worden cellen in een zure salicylzuur omgeving gebracht. Levende cellen hebben een neutrale pH en proberen deze pH te behouden. Aangezien het salicylzuur fluoresceert bij neutrale pH is dit meetbaar. Bij dode cellen vormt de celmembraan geen barrière meer en is de pH dezelfde als de pH van de omgeving. De pH in de experimenten is zo gekozen dat uiteindelijk alle cellen afsterven. Hoe langer de cellen een inwendig neutrale pH kunnen behouden, hoe robuuster het celtype. Zo neemt het signaal in sporen veel langzamer af dan in vegetatieve cellen en kan dus op basis van verschil in signaalafname onderscheid worden gemaakt. Of nog, hoe hoger de intensiteit van het fluorescente signaal, hoe meer levensvatbare cellen
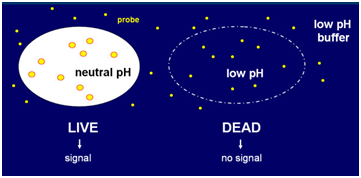
Figuur. Principe van RTV meting (Bron Kort et al. BMC Biotechnology 2010 10:45)
De fysiologische conditie van cellen kan snel en high-throughput geëvalueerd worden via het opvolgen van de afname van fluorescentie. Klassieke uitplaatmethoden vergen minimaal een dag incubatie en enkel micro-organismen die, onder lab omstandigheden kolonies vormen, kunnen uitgroeien. De RTV experimenten zijn eenvoudig uit te voeren. In experimenten met microtiter platen kunnen veel stalen tegelijk geanalyseerd worden.
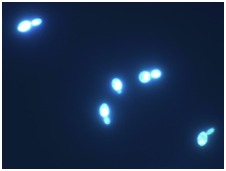
Figuur. Fluorescentie van S.cerevisiae cellen (Bron Kort et al. BMC Biotechnology 2010 10:45)
In principe is de methode toepasbaar voor verschillende celtypes zoals bacteriën, bacteriesporen, gisten, schimmels en schimmelsporen. Totnogtoe werd de methode in praktijk met succes getest bij starterculturen en probiotica. Voor voedingsproducten is de methode nog niet direct te gebruiken omwille van de lagere aantallen micro-organismen en de complexe matrices. TNO ontwikkelt op dit moment een apparaat voor detectie van micro-organismen in vloeistoffen en lucht, waarbij de micro-organismen direct kunnen worden aangetoond met de hierboven beschreven methode.
Bronnen
- Real-time detection of viable microorganisms by intracellular phototautomerism, Remco Kort, Andreas Nocker, Alie de Kat Angelino-Bart, Sjaak van Veen, Herman Verheij, Frank Schuren en Roy Montijn. BMC Biotechnology 2010, 10:45doi:10.1186/1472-6750-10-45. http://www.biomedcentral.com/1472-6750/10/45
- Snelle screening fysiologische conditie micro-organismen. VMT 21 (2010). www.vmt.nl